FX classix
Principais características
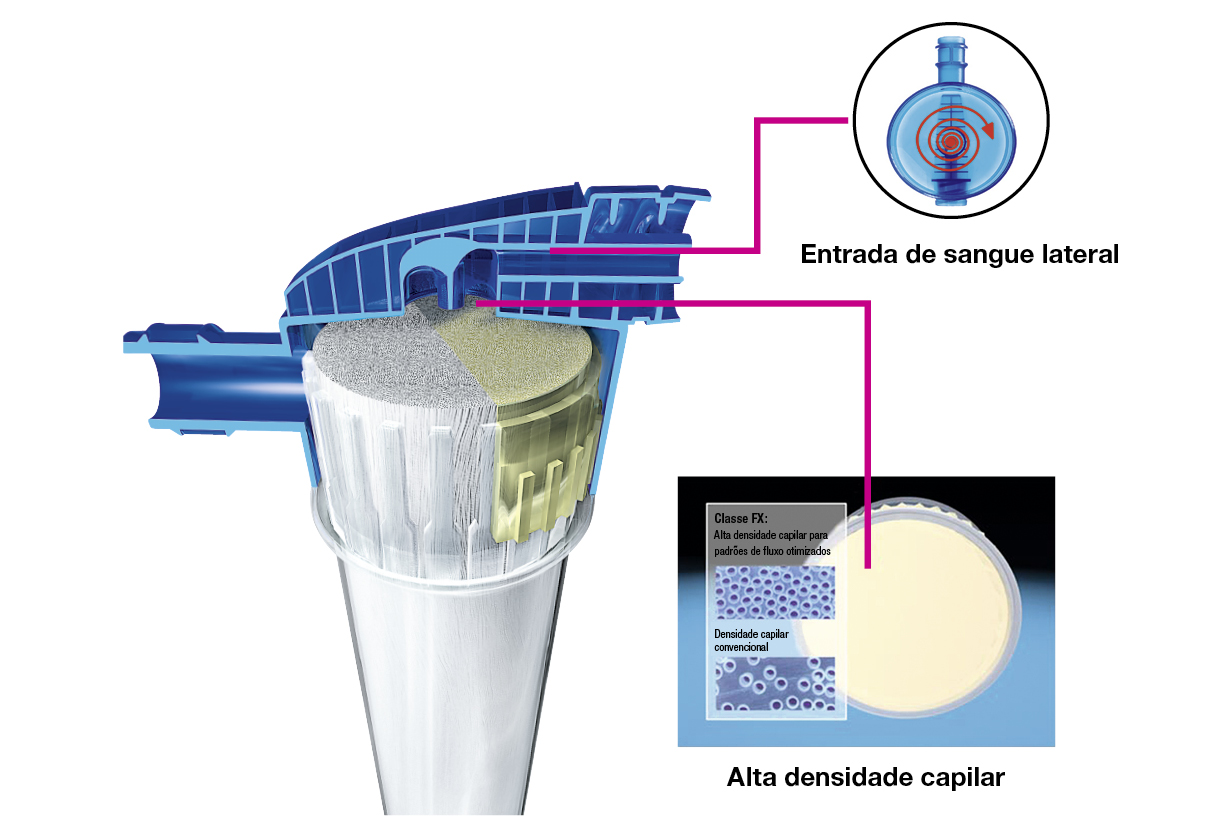
Condições otimizadas de fluxo de sangue
- A porta de entrada de sangue lateral proporciona um fluxo de sangue homogéneo no topo do dialisador, evitando zonas de estagnação. O design minimiza o risco de dobras nas linhas, contribuindo para o aumento da segurança.
- A alta densidade capilar leva a uma distribuição mais uniforme das fibras. Isso permite uma distribuição homogénea da entrada do fluxo de sangue em cada fibra.
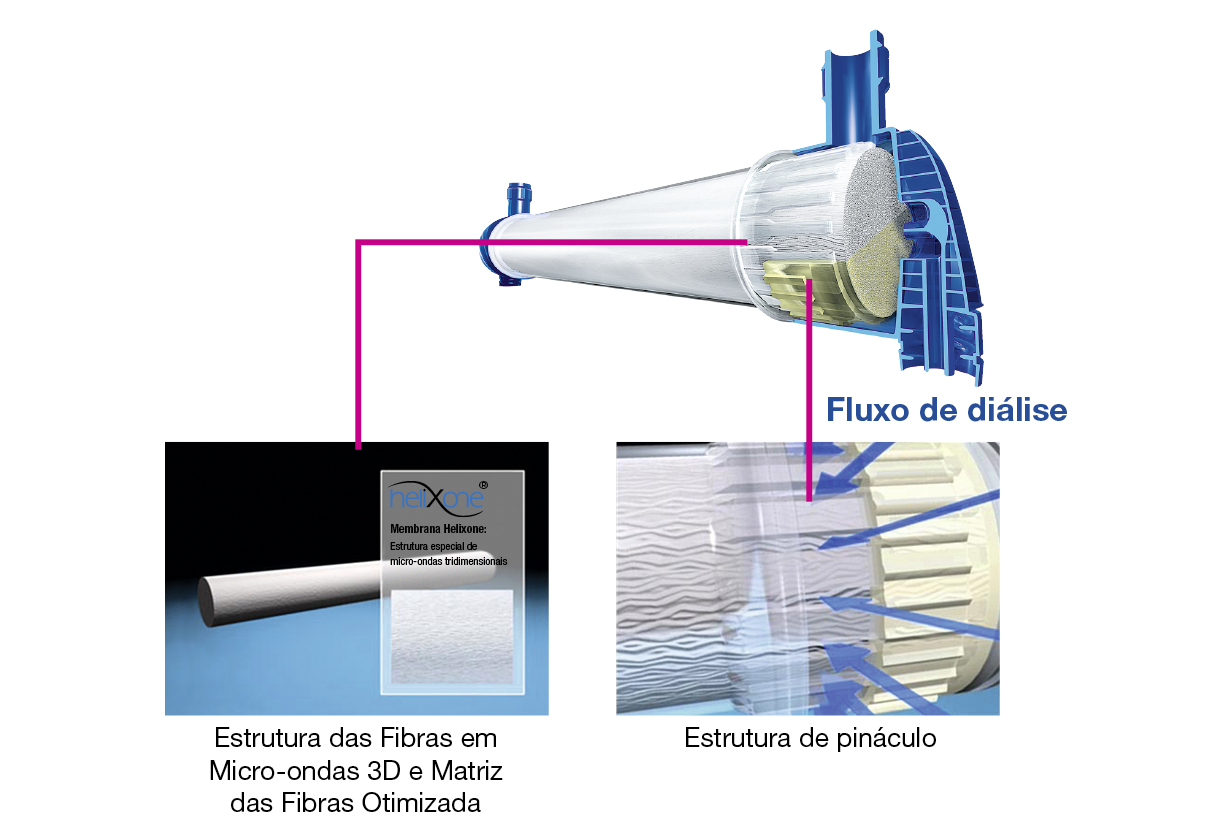
Fluxo homogéneo de dialisante para depuração melhorada
- A porta de entrada de sangue lateral proporciona um fluxo de sangue homogéneo no topo do dialisador, evitando zonas de estagnação. O design minimiza o risco de dobras nas linhas, contribuindo para o aumento da segurança.
- A alta densidade capilar leva a uma distribuição mais uniforme das fibras. Isso permite uma distribuição homogénea da entrada do fluxo de sangue em cada fibra.
O design do invólucro da classe FX®
O design da classe FX®
Peso do dialisador.
| O peso do dialisador é um fator crucial, não apenas em logística, mas também na gestão de resíduos. O invólucro dos dialisadores da classe FX® é feito de polipropileno. Em comparação com o policarbonato, amplamente utilizado, é muito mais leve, o que significa que os dialisadores da classe FX® têm aproximadamente metade do peso da maioria dos dialisadores. | |
| FX 60 classix | 107g |
| FX CorDiax 60 | 107g |
Peso dos dialisadores da classe FX®
Os benefícios da esterilização a vapor INLINE
| Sem resíduos químicos | Não há necessidade de esterilização gama – a radiação ionizante de alta energia pode reduzir a capacidade e alterar a química do material. |
| Baixos volumes de enxague | Tempo mínimo de preparação – como os dialisadores estão limpos quando chegam, os tempos de enxague antes do uso são substancialmente reduzidos. |
| Menos enxagues – menores custos | Menos volumes de enxague significam menores custos e reduzido tempo de preparação. |
Tecnologia
Melhor clearance, por meio de nanotecnologia
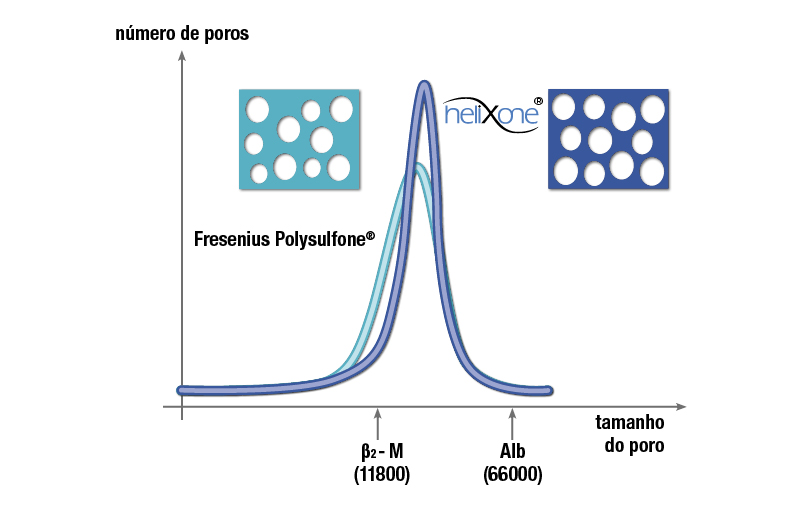
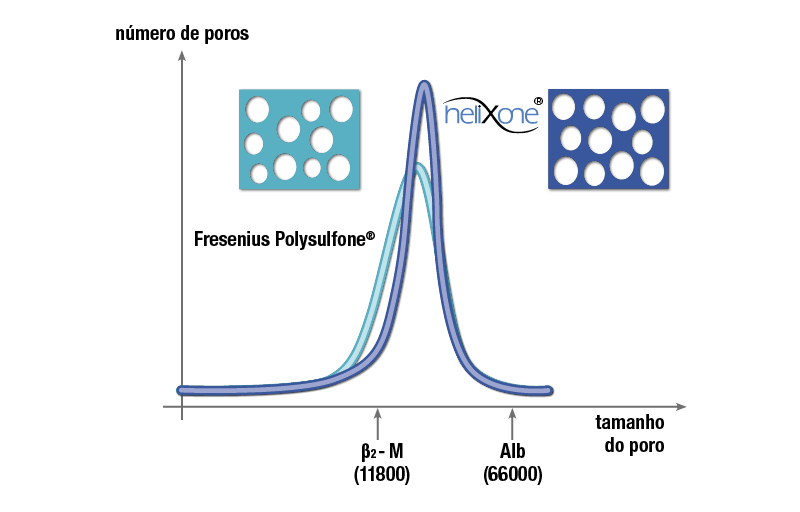
Forma dos poros da Helixona
Forma dos poros da Helixona
Quando os dialisadores da clase FX® foram lançados no mercado, uma inovadora tecnologia de spinning havia sido desenvolvida para produzir a membrana Helixone®. A chamada tecnologia Nano Controlled Spinning (NCSTM) permitiu a produção de estruturas de poros altamente definidos. Ao contrário dos poros convencionais produzidos anteriormente, de formato enrugado e irregular, os poros na camada interna da membrana Helixone® são lisos e cilíndricos. Isso reduz a resistência das moléculas quando se deslocam através dos poros e, portanto, permitem uma remoção otimizada.
Espectro de poros otimizados por meio da nanotecnologia
Todas as membranas Helixone® têm propriedades de filtragem otimizada, pois a distribuição de tamanhos dos poros foi reduzida em relação às membranas anteriormente produzidas, como as utilizadas, por exemplo, na série F. O tamanho médio dos poros é maior em comparação com os dialisadores da série F, e a variação no tamanho dos poros é menor. Isso resulta em melhor permeabilidade seletiva para médias moléculas, ou seja, uma proporção mais favorável de filtragem de β2-m/albumina.
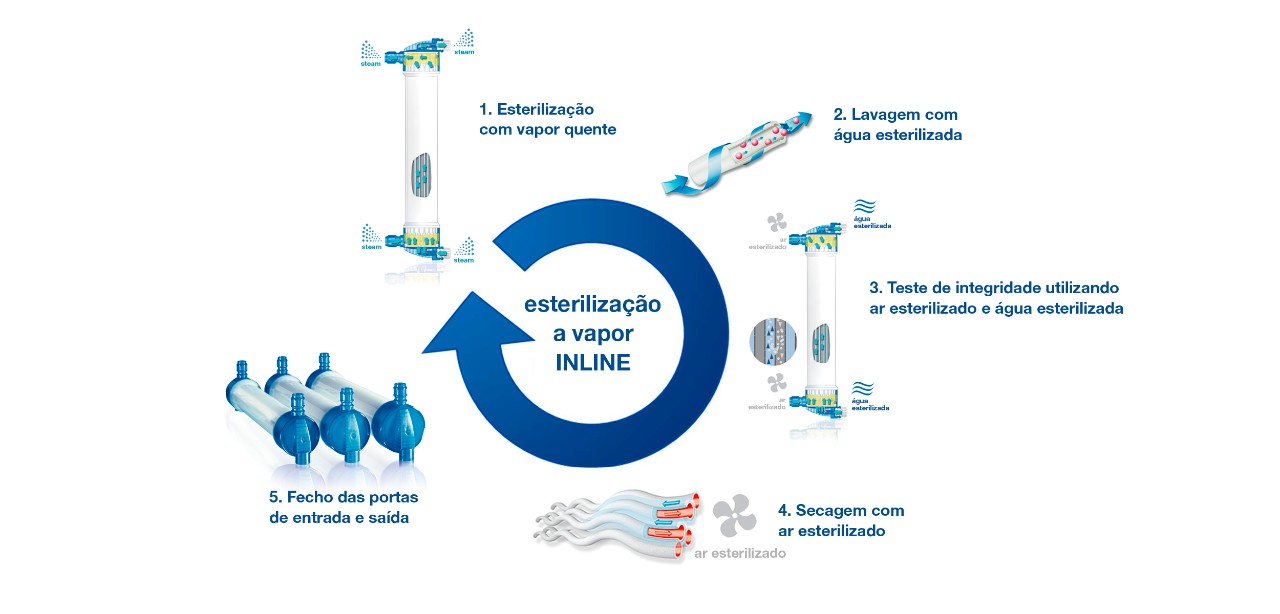
Esterilização a vapor INLINE
Processo de esterilização a vapor INLINE
Os benefícios do processo de esterilização a vapor INLINE
- Dialisadores com alto grau de pureza, estéreis e livres de pirogénios, sem quaisquer resíduos potencialmente prejudiciais provenientes do processo de esterilização.
- A biocompatibilidade das membranas permanece inalterada desde a esterilização.
- Uso otimizado de recursos devido a baixos volumes de lavagem: Apenas 500 ml são necessários.
- Risco minimizado de fugas de sangue e roturas de fibras devido a testes de 100% de integridade das fibras.
- Dialisadores secos com risco minimizado de contaminação devido ao crescimento microbiano
Teste de integridade das fibras
Todos os dialisadores precisam passar no teste de ponto de bolha. Aqui, o ar estéril é pressionado no compartimento do dialisante, enquanto o compartimento de sangue contém água estéril. Se houver alguma fuga na membrana, o ar passaria pela membrana e criaria bolhas. Esse teste de integridade minimiza o risco de roturas de fibras e, portanto, de fugas de sangue.
Alta capacidade de retenção de endotoxinas da Helixone®
Weber et al. (2003) comparou a capacidade de adsorção de endotoxinas de diferentes dialisadores.
A membrana Helixone® de um dialisador FX 60 tinha maior capacidade de adsorção de endotoxinas, em comparação com:
- Polyflux® 140H da Gambro: Polietersulfona (Poliamida S)
- Nephral® ST 400 da Gambro - Poliacrilonitrilo (AN69ST)
- Diacap® HI PS 18 da B.Braun - Alpha- Polissulfona
Dados de performance
| FX classix dialisadores de alto fluxo | FX 50 classix | FX 60 classix | FX 80 classix | FX 100 classix | |
|---|---|---|---|---|---|
| Clearance (QB = 300 mL/min) | Peso Molecular (Dalton) | ||||
| Citocromo c | 12,230 | 55 | 74 | 89 | 100 |
Inulina |
5,200 | 72 | 95 | 113 | 122 |
| Vitamina B12 | 1,355 | 137 | 162 | 185 | 201 |
Fosfato |
132 | 204 | 225 | 244 | 253 |
| Creatinina | 113 | 224 | 243 | 259 | 264 |
| Ureia | 60 | 253 | 266 | 279 | 280 |
| Clearance (QB = 400 mL/min) | |||||
| Citocromo c | 12,230 | 76 | 92 | 105 | |
| Inulina | 5,200 | 99 | 119 | 129 | |
| Vitamina B12 | 1,355 | 175 | 202 | 222 | |
Fosfato |
132 | 252 | 279 | 291 | |
| Creatinina | 113 | 277 | 300 | 309 | |
| Ureia | 60 | 312 | 334 | 336 | |
| Coeficiente de ultrafiltração (mL/h x mm Hg) | 27 | 38 | 53 | 68 | |
Coeficientes de filtragem |
|||||
| Albumina | 66,500 | < 0.001 | |||
| Mioglobina | 17,053 | 0.1 | |||
| β2-microglobulina |
11,731 |
0.7 | |||
| Inulina | 5,200 | 1 | |||
| Desempenho in vitro: QD = 500 mL/min, QF = 0 mL/min, T = 37°C (ISO8637). Coeficientes de ultrafiltração: sangue humano, Hct 32 %, Teor de proteína 6 %. | |||||
| Material da membrana |
Helixone® | ||||
| Método de esterilização |
Vapor INLINE | ||||
| Material de armazenamento |
Polipropileno | ||||
| Composto de vasos |
Poliuretano | ||||
| Unidades por caixa |
24 | ||||
| Superfície eficaz (m²) | 1.0 | 1.4 | 1.8 | 2.2 | |
| K0A Ureia | 866 | 1,068 | 1,394 | 1,429 | |
| Volume inicial (mL) | 53 | 74 | 95 | 116 | |
| Número do artigo | F00002385 | F00002386 | F00002387 | F00002388 |
1 Weber V. et al., Blood Purification (2003); 21: 365.