stay•safe System unterstützt Patienten auf einfache und bequeme Weise bei der täglichen und eigenständig durchgeführten CAPD-Behandlung.
APD
Warum automatisierte Peritonealdialyse (APD)?
Die APD nutzt ein programmierbares Gerät, Cycler genannt, welcher das Volumen, die Befüllung, die Verweilzeit und die Drainage des Dialysats steuert. Dank der automatisierten Dialyse können die Patienten auch im Schlaf zu Hause dialysiert werden.
Da die APD die Freizeit am Tage erhöht, kann dieses PD-Verfahren Vorteile für die Lebensführung des Patienten bieten. Die Patienten können ihrer Arbeit nachgehen und haben mehr Zeit für private und familiäre Aktivitäten.1
Zudem bietet der APD-Cycler eine Vielzahl von Optionen zur Individualisierung der Behandlung. Dadurch können Sie die Bedürfnisse Ihrer Patienten noch besser berücksichtigen und so die Patientenversorgung weiter verbessern.
Erste Schritte in der Unterweisung für die APD – Wenn aus dem Schwierigen das Einfache wird
FMC hat Schulungslösungen entwickelt, die sich auf die relevanten Informationen konzentrieren, und bietet Unterstützung bei der Vorbereitung und Einrichtung der Behandlungsgeräte.
Die wichtigsten Funktionen von sleep•safe harmony
sleep•safe harmony bietet Funktionen für eine verbesserte Patientenversorgung. Der Cycler bietet auch Schulungsunterstützung in Form von anleitenden Bildschirmanimationen direkt am Gerät.
- Erstellen Sie Verschreibungen direkt am Gerät
- Bildschirmtastatur
- Verbesserter Flüssigkeitsverbrauch – kein zusätzliches Volumen für das Vorfüllen erforderlich
- Zulässiges Patientenvolumen – das maximale individuelle Füllvolumen
- Zulässiges Restvolumen – das maximale individuelle Volumen, das in der Bauchhöhle des Patienten verbleiben darf
- Das Ziel ist:
- die Auslaufalarme weitgehend zu reduzieren – für einen ruhigeren und erholsameren Schlaf
- die verschriebene Behandlungszeit einzuhalten
- eine gesteigerte Wirksamkeit der Behandlung
- mehr Flexibilität bei der Durchführung der Behandlung innerhalb festgelegter individueller Grenzen, um das Wohlbefinden und die Sicherheit der Patienten zu verbessern
- Automatische Konnektion und Barcode-Erkennung von Beuteln
- Integrierte Griffe
- Die PatientCardplus kann bis zu neun verschiedene Verschreibungen und Behandlungsdaten von mehr als 12 Monaten speichern
- Automatische Inline-Erwärmung des fließenden Dialysats auf Körpertemperatur unmittelbar während der Einlaufphase – kein Vorwärmen des Dialysatbeutels vor der Behandlung erforderlich
- Automatische Drainagefunktion – die Dialysatbeutel und das Schlauchset werden automatisch entleert, ohne dass ein manueller Schritt erforderlich ist
- Plug & use – dank der Doppelinstallation ist kein Transformator erforderlich
- Animierte Anleitungen direkt auf dem Gerät
- Großer Touchscreen
- Die für den täglichen Gebrauch vorgesehenen Verbrauchsmaterialien des sleep•safe harmony Systems bestehen aus PVC- und weichmacherfreien Materialien wie Biofine (mit Ausnahme der APD-Drainageprodukte)
Weil jeder Patient anders ist: aAPD – Fischbach et al.2 sehen bei gleichbleibendem Zeit- und Ressourcenaufwand potenziell bessere Ergebnisse2
Ihre Patienten mit einer chronischen Erkrankung unterscheiden sich in vielerlei Hinsicht voneinander: Alter, Größe, Gewicht, Krankheitsstadium, Restnierenfunktion usw. Diese Unterschiede haben einen Einfluss auf die Entscheidung, welche PD-Behandlung erforderlich ist.
Die Bedürfnisse der Patienten sind unterschiedlich:
Das Alter ist ein wichtiger Faktor bei der Wahl der Dialysemodalität. Patienten mit ausreichend Geschick und Motivation sind gute Kandidaten für die PD. Mit zunehmendem Alter können sich die Begleiterkrankungen von Dialysepatienten verschlechtern und damit auch deren Gebrechlichkeit.
Die Gewichtskontrolle ist ein wichtiger Erfolgsfaktor bei PD-Patienten. Gewichtsveränderungen aufgrund von Lebensweise, Kalorienaufnahme, Krankheit und Hydratationsstatus erfordern eine konstante Überwachung und Anpassung der PD-Therapie.
Ein gängiges Maß zur Beurteilung der peritonealen Transporteigenschaften bei PD-Patienten ist das Dialysat-Plasma-Verhältnis. Je nach Zustand ihrer Peritonealmembran können Patienten in hochpermeable (schnelle), durchschnittlich permeable und geringpermeable (langsame) „Transporter“ unterteilt werden. Die Transporteigenschaften der Peritonealmembran ändern sich unter dem Einfluss der PD im Laufe der Zeit. Daher wird eine regelmäßige Überwachung des D/P-Kreatinins und eine anschließende Anpassung der PD-Verschreibungen empfohlen.
Je nach Funktionsgrad ihrer Peritonealmembran werden Patienten in hochpermeable (schnelle), durchschnittlich permeable und geringpermeable (langsame) „Transporter“ unterteilt. Im Laufe der Zeit und mit zunehmender Verweildauer bei der PD werden die Patienten in der Regel zu schnellen Transportern. Um ein optimales Behandlungsergebnis zu erzielen, müssen PD-Verschreibungen an den Transporttyp der Patienten angepasst werden.
Die RKF (residual kidney function, Restnierenfunktion) hat einen Einfluss auf das Überleben und die Lebensqualität von Dialysepatienten mit PD. Dementsprechend ist die möglichst lange Erhaltung der RKF von entscheidendem Vorteil. Daher sind Interventionen zur RKF-Erhaltung wichtig, wie die Verschreibung biokompatibler PD-Lösungen.
Aufgrund der beeinträchtigten Nierenfunktion nimmt die Fähigkeit des Körpers, überschüssige Flüssigkeit auszuscheiden, ebenfalls ab, und die Patienten benötigen Dialyse, um die erforderliche UF zu leisten. Die benötigte UF-Menge hängt von vielen Faktoren ab, wie Lebensweise, Krankheitsprogression und Begleiterkrankungen. Daher ist eine ausreichende UF für eine erfolgreiche PD entscheidend.
Kt/V-Harnstoff ist die Harnstoffclearance, die auf das Gesamtkörperwasser normalisiert wird. Dies ist ein wichtiger Parameter, um die Eignung des Patienten für die PD zu überprüfen. Für PD-Patienten wird ein Kt/V-Harnstoffgesamtwert von mindestens 1,7 pro Woche empfohlen.5
Erreichen von Adäquatheitszielen
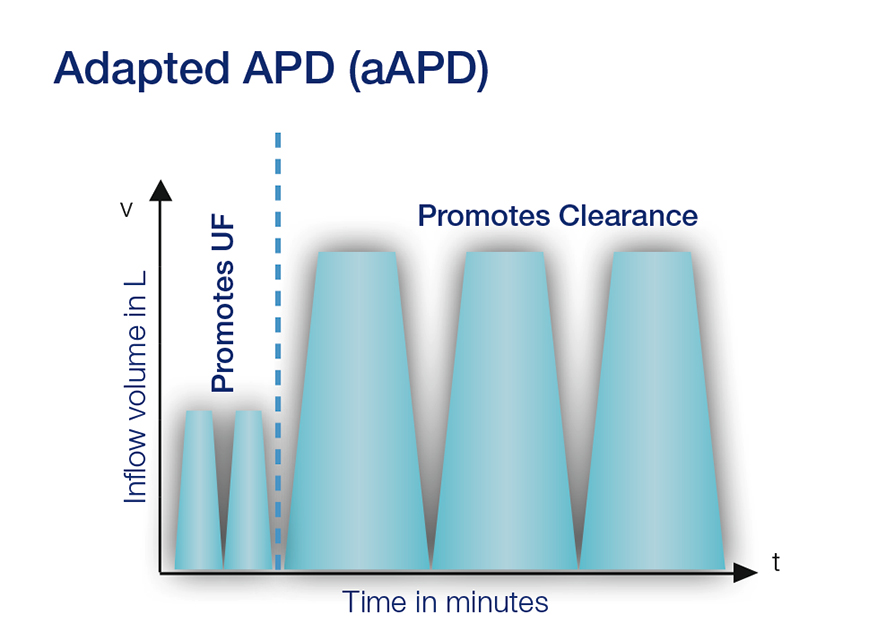
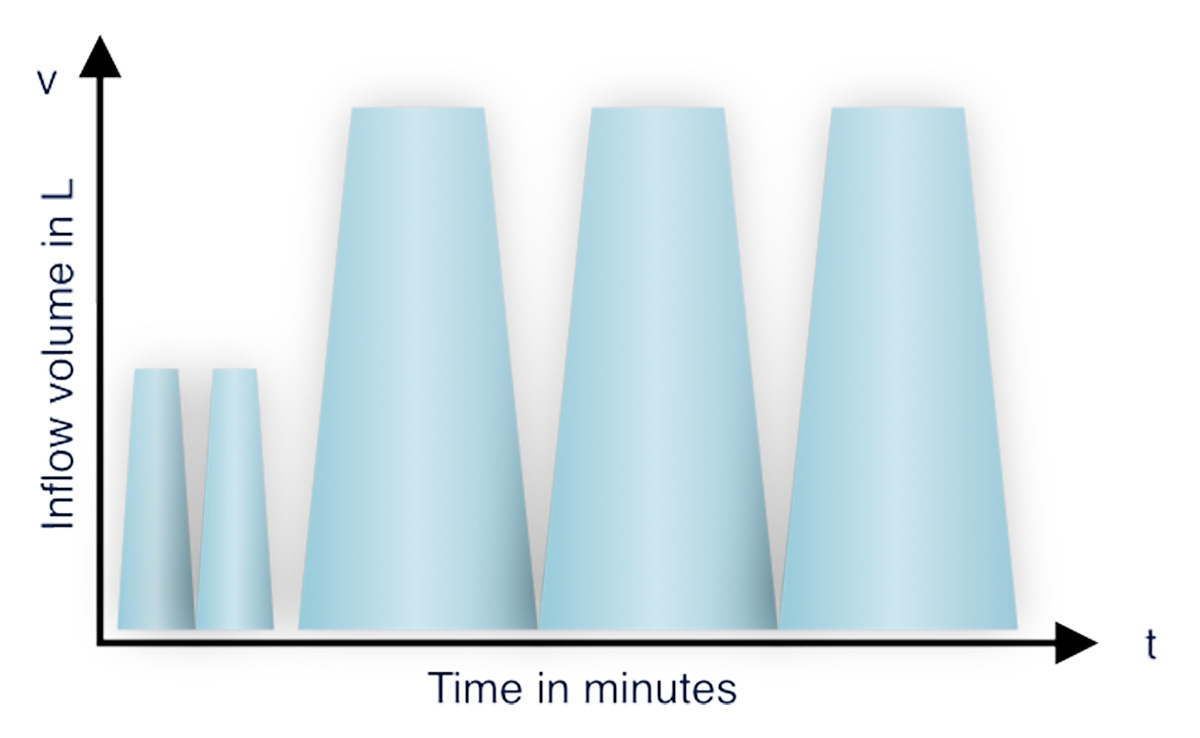
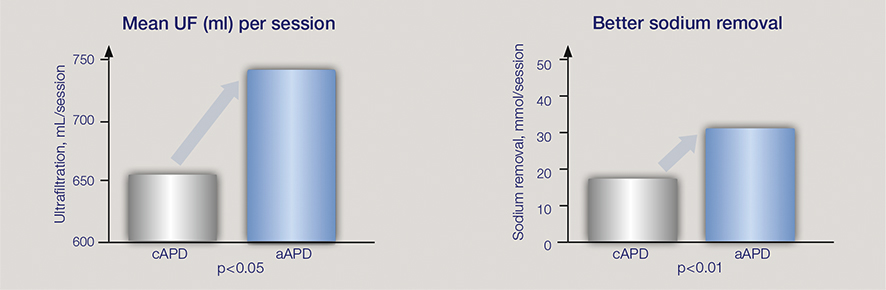
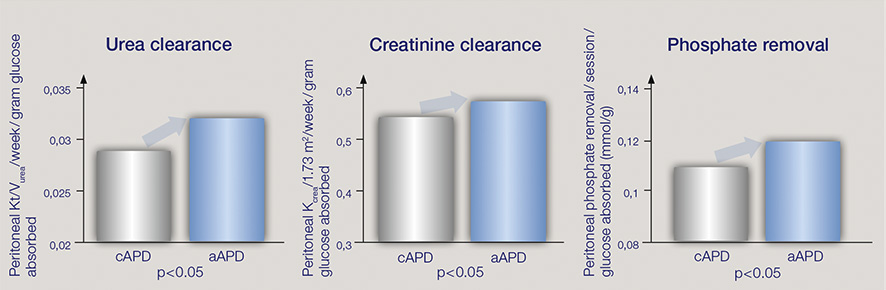
Der aAPD-Ansatz wurde von Fischbach M. et al. vorgeschlagen.2 Durch die Kombination von Sequenzen aus kurzen Verweilzeiten und kleinen Füllvolumina mit langen Verweilzeiten und großen Füllvolumina fördert aAPD die UF und Clearance innerhalb einer PD-Sitzung. Die pro Gramm absorbierter Glukose erzielte Blutreinigung und UF lag bei der aAPD höher als bei der herkömmlichen APD.
Die Herausforderungen der PD – Erreichen der Adäquatheitsziele
Das Erreichen der Adäquatheitsziele für UF und Clearance ist bei der PD eine Herausforderung. Fischbach et al. schlagen vor, dass kürzere Verweilzeiten und kleinere Füllvolumina den Prozess der UF fördern, während längere Verweilzeiten und große Füllvolumina die Clearance von gelösten Substanzen erhöhen.2 Die vorgeschlagene Strategie hat das Potenzial, beides innerhalb ein und derselben PD-Sitzung zu verbessern.
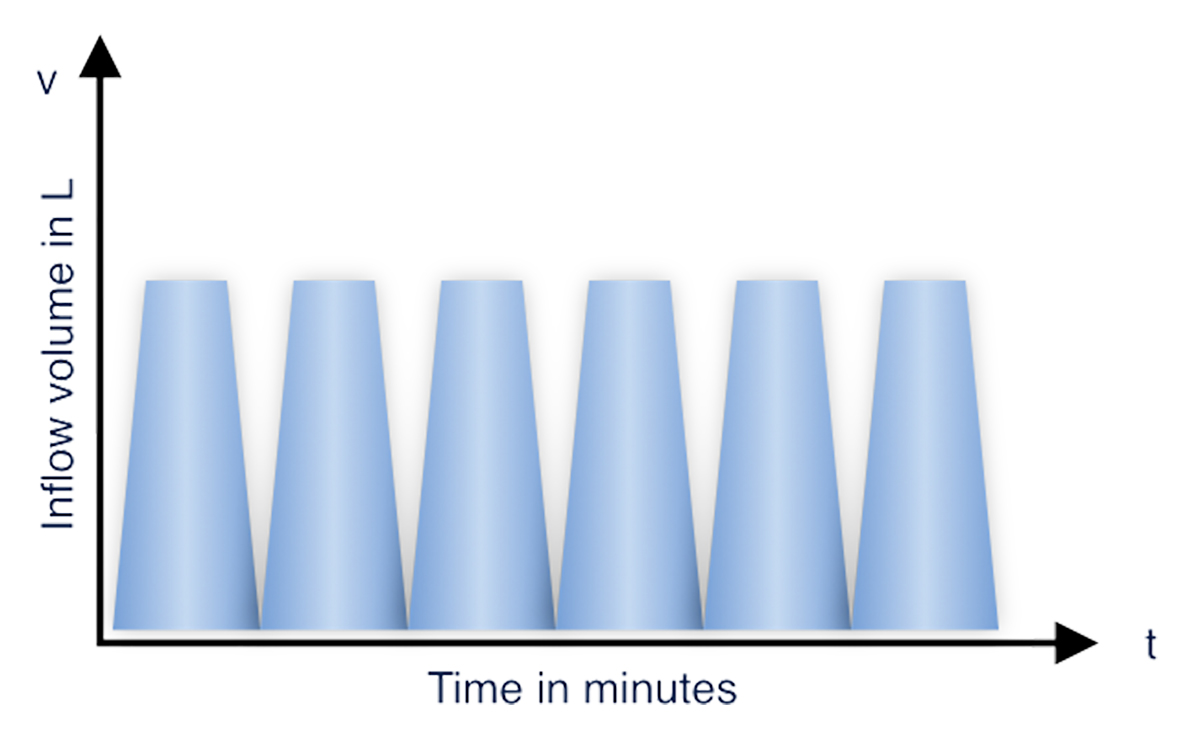
cAPD
aAPD
aAPD
Die Studienergebnisse deuten darauf hin, dass durch die Variation von Verweilzeiten und Füllvolumina zur gezielten Verbesserung entweder der UF oder der Clearance die Dialyse im Vergleich zur herkömmlichen APD insgesamt adäquater und die metabolische Belastung geringer ausfällt.2